本ブログの御訪問ありがとうございます。
機械設計をやっていますT.surfと言います。
機械設計をやっている管理人が
本記事で、以下をわかりやすく解説します。
【高校物理】
気体の性質とモル数と状態方程式
⇩本記事を以下の方におススメです⇩

気体だけなんで
モル数とか
気体定数とか
状態方程式とか
あるの?
⇩本記事を読むと以下が わかります⇩

気体の性質は
液体と固体とは
あきらかに
違う性質があります。
結論
物質の状態には
固体 液体 気体
という3つの状態があります。
固体になるにしたがって分子の運動が
収縮し一点になります。
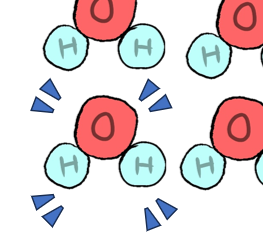
気体になればなるほど、分子の運動が
激しくなり拡散します。
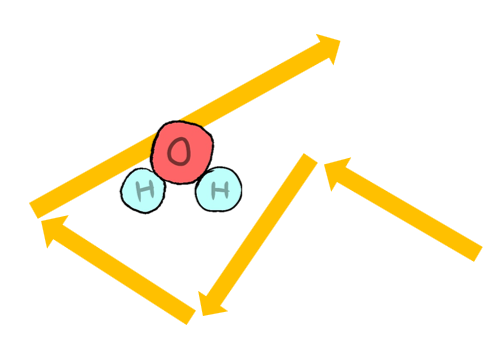
よくある解釈として
- 低温で固体になり、
- 高温になると気体になる
と思っているかもしれません。
確かに
低温では分子の運動エネルギーが少なくなり分子の運動が収束
高温では分子のエネルギーが大きくなり分子の運動が拡散
となります。
しかし 個体や液体 気体の状態はあくまで
分子の運動が収束しているか拡散しているかであり、
温度はその要因の1つでしかありません。
例えば、
固体は分子の運動が1点に収縮した状態ですが
何もそれは温度だけが要因なのではありません。
超高圧な環境では、温度に関係なく1点に収縮します。
つまり・・・
- 超高圧下では高温で氷になる場合もあります。
- 逆に圧力が低いと低温で沸騰します。
気圧の低い富士山では80℃で沸騰したりしますよね?
気体の面白い性質
固体 液体 気体の3相の内
気体状態は少し変わった特性を持っています。
物質の分子にエネルギーが多くある状態で
飛び回っている状態であり、
固体や液体と違い分子間の距離が結構あります。
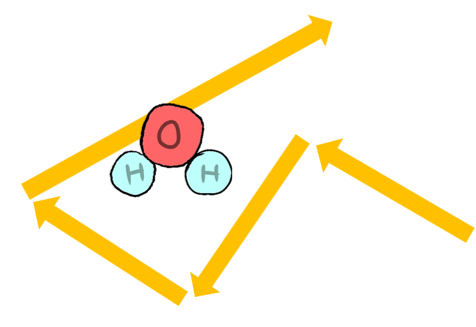
なので、気体は圧縮すると
体積が劇的に小さくなり、その分圧力が劇的に上がります。
しかし、固体や液体はもともと分子間の距離が小さいため
圧縮しても気体ほど劇的に体積は小さくなりません。
気体の状態方程式
気体は圧力と体積、温度と言った要素が
以下の式で成り立つ性質があります。
PV=nRT
これを気体の状態方程式といい、
| 圧力 | P | 単位:Pa |
| 体積 | V | 単位:m3 |
|
温度 |
T | 単位:K |
| モル数 詳しくは後述 |
n | 単位:mol |
| 気体定数 詳しくは後述 |
R | 単位:Pa・m³ (K・mol) |
となります。
温度についての補足
温度には2つの単位があります。
- よく使う摂氏 単位:℃
- 絶対温度 単位:k(ケルビン)
摂氏は水が氷る温度を0℃としている温度表記です。
ですが、絶対温度とは全ての分子が停止(1点に収縮)
する温度-273℃を0k(ケルビン)としている温度表記です。
物理や化学の計算では絶対温度を用います。
モル数とアボガドロ定数
先ほど御紹介した式のnはモル数と解説しました。
モル数を説明する前に気体の面白い性質を
説明しなくてはいけません。
気体はどういったわけか気体を構成する原子
(もしくは分子)の大きさに関わらず、
同じ圧力、温度 体積のもとでは
同じ数詰め込まれています。
気体分子(原子)の大きさに関わらずです。
以下のようなイメージです。
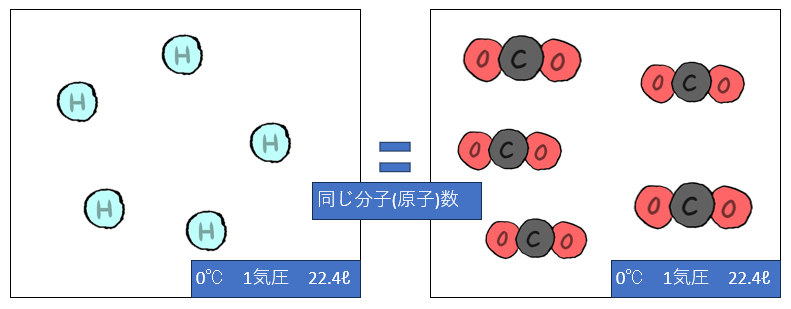
不思議ですね。
ということで、以下の条件の場合
- 1気圧の圧力
- 0℃の温度
- 22.4Lの体積
であれば
必ず6.02×1023の気体分子(原子)が含まれてるのです。
この6.02×1023という数字を
アボガドロ定数と言うとともに
この数を1モルと表現します。
気体定数
気体定数とは理想気体における
状態方程式の定数です。
R=8.31×10³ Pa・m³/(K・mol)
気体定数は単位の表現が豊富で一例として
Pa=N/m²ですので
R=8.31×10³ N・m/(K・mol)
と表現する場合もあります。
この気体定数の存在と状態方程式見ると
あくまで
- 圧力
- 体積
- 分子数
- 温度
に状態が左右されているのであって
分子の大きさや原子の大きさは関係ない事に
なりますね。
理想気体
確かに気体の状態は分子の大きさによらず
一定の性質を示します。
ですが、さずがに極限状態ではそうもいきません。
その極限状態とはどういった状態か?
超高圧や超低温など
分子間距離が縮みきるような環境下です。
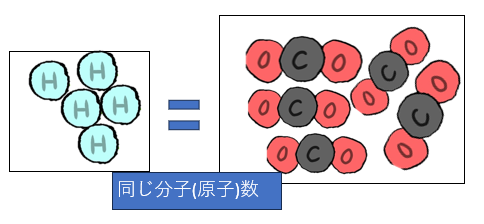
さずがに分子間距離が近くの分子と隣接する状況下では
体積に影響が出てきます。
このように、気体の状態方程式は
通常の気体では超低温化 超高圧化において
成り立たなくなります。
ですが、気体の状態方程式は、
分子(原子)の大きさに関わらず、
どんな超低温化 超高圧化における極限状態
でも気体定数に比例して状態方程式が
成り立つことを前提としてます。
(もちろん極限状態では成り立ちませんが)
このどんな超低温下 超高圧化のおいても
状態方程式が成り立つ気体を
理想気体と言います。
状態方程式の利用上の注意
つまり、先述の気体の状態方程式である
PV=nRT
は理想気体でのみ成り立つものであると
言えます。
ですが、現実の気体が理想気体と著しく
異なってくるのは極限状態のみとなり、
通常扱う環境下では、
現実の気体≒理想気体
となり、
精度よく成り立ちます。
つまり、気体の状態方程式を使う際の注意は
- 状態方程式の対象物は理想気体であるが・・・
- 通常の環境下では理想気体≒現実の気体
- 極限状態では成り立たない
ということを理解することです。